- RESEARCH USING SomaScan -
- SomaScan®を用いた研究は1,000報以上報告されています。
- 心血管疾患、糖尿病等の生活習慣病の他、感染症、悪性新生物、希少疾患、認知症、免疫疾患関連など様々な疾患領域での研究に使用され、薬剤応答試験、介入評価、術後評価などに活用されています。
研究例① 改良型SOMAmer®はヒトプロテオームの半数を測定する次世代プロテオミクスです。
この論文では、ヒトの全タンパク質の約半数を同時に高感度で測定可能な新しいプロテオーム解析技術「SomaScan®」アッセイの開発と応用について紹介しています。SomaScan®は、抗体の代替となる改良型アプタマー「SOMAmer®(Slow Off-rate Modified Aptamer)」を用いたアフィニティベースの手法で、従来の抗体法では困難だった高い特異性と多重性(マルチプレックス性)を実現しています。
この技術では、タンパク質とSOMAmer®との結合の安定性(オフレート)を利用した「キネティック・プルーフリーディング(kinetic proofreading)」という工程を複数段階で導入することで、非特異的な結合を排除し、真に標的となるタンパク質のみを高精度に検出できます。さらに、SomaScan®はDNA検出技術(マイクロアレイや次世代シーケンシング)と組み合わせることで、タンパク質の存在量を定量的に測定することが可能です。
最新の「SomaScan® 11K」アッセイでは、11,038種類のSOMAmer®試薬を用いて、10,070種類のユニークなヒトタンパク質を網羅的に測定できるようになっており、これはヒトゲノムにコードされるタンパク質の約半数に相当します。この広範なタンパク質カバレッジにより、疾患の診断・予測、薬剤応答の評価、個別化医療(プレシジョン・メディシン)への応用が期待されています。
さらに、機械学習を活用して複数のタンパク質の変化パターンを解析することで、心血管疾患や糖尿病などのリスクを予測する「SomaSignal」テストも開発されており、臨床現場での活用が進んでいます。SomaScan®は、今後のバイオマーカー探索や創薬、疾患メカニズムの解明において、非常に有望なプラットフォームと位置づけられています。
研究例② SomaScan® AssayとOlink®の補完性を明らかにしました。
Grimur L. et al. Large-scale plasma proteomics comparisons through genetics and disease associations. Nature volume 622, pages348–358 (2023)
この研究では、2つの主要な高精度プロテオミクス技術「Olink Explore 3072」と「SomaScan® v4」を用いて、ヒト血漿中のタンパク質レベルと遺伝的変異との関連を大規模に解析し、疾患との関係を比較・検証しました。英国バイオバンク(UK Biobank)とアイスランドのコホートから得られた約9万人のデータを用いて、両プラットフォームの測定精度、再現性、遺伝的関連(pQTL)の検出能力を評価しました。
その結果、両プラットフォームで測定されたタンパク質レベルの相関は限定的であり、同じタンパク質を対象としていても、異なるプロテオフォーム(タンパク質の構造的バリエーション)を検出している可能性が示唆されました。特に、SomaScan®ではアプタマーを用いた測定であり、Olink®は抗体ベースの測定であるため、検出対象や感度に違いが生じていると考えられます。
また、両プラットフォームで検出されたpQTL(タンパク質量に影響する遺伝的変異)の比較により、疾患関連遺伝子との関係性や、民族的背景による違い(特にアフリカ系集団での精度向上)も明らかになりました。これにより、プロテオミクスとゲノミクスの統合解析が、疾患の理解やバイオマーカーの発見において重要な役割を果たすことが示されました。
研究例③ SomaScan® Assayの高感度・大規模測定技術は、フレイル研究のバイオマーカー開発に大きく貢献しました。
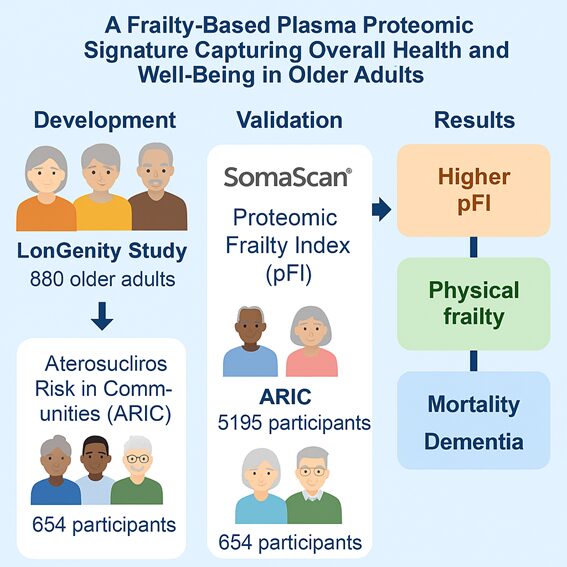
フレイルは加齢に伴う多面的な生理機能低下を特徴とし、転倒や入院、死亡といった不良転帰のリスクを高める老年期特有の症候群です。しかし、その複雑な病態のため血液ベースの頑健なバイオマーカーはこれまで確立されていません。本研究では、大規模プロテオーム解析技術である SomaScan アッセイ を用いて血漿中の数千種類のタンパク質を測定し、フレイルを捉える25種類のタンパク質からなる「プロテオーム・フレイル指標(proteomic Frailty Index: pFI)」を構築することを目的としました。
研究は3つの独立した加齢コホートを用いて実施されました。LonGenity研究(n=880, 平均年齢75歳):アシュケナージ系ユダヤ人を中心とする高齢者集団。Atherosclerosis Risk in Communities(ARIC)研究(n=5195, 平均年齢76歳):米国4地域の大規模住民コホート。Baltimore Longitudinal Study of Aging(BLSA)(n=654, 平均年齢77歳):ワシントンDC地域を対象とする縦断研究。各コホートで保存血漿を用い、SomaScan v4.0/v4.1 により4,000~7,000種類以上のタンパク質を定量しました。
ステップ1(開発):LonGenity研究において、4265種類のタンパク質をスクリーニングし、フレイル指数(FI)と有意に関連する143種類を同定。その後Elastic Net回帰により25種類を選抜し、pFIを構築しました。ステップ2(検証):ARIC(5,195名)とBLSA(654名)に適用し、従来のFIとの相関、身体的フレイルとの関連、死亡・認知症発症などの予測能を検証しました。
LonGenity研究:pFIはFIと中程度の相関(r=0.58)を示し、上位3分位群では下位群に比べ死亡リスクが4倍以上高いことが示されました。ARIC研究:pFIとFIの相関はr=0.61で、pFI高値群では全死亡リスクが有意に高く(HR=1.13)、また糖尿病・高血圧・心不全など慢性疾患との強い関連が確認されました。さらに7年間の追跡で認知症発症リスク上昇(HR=1.07)が認められました。BLSA研究:FIとの相関はr=0.45。死亡リスクや身体機能(握力・歩行速度低下)とも関連しました。
本研究は、SomaScanを用いた網羅的プロテオーム解析により、25種類のタンパク質からなる新しいフレイル指標pFIを開発し、複数の大規模独立コホートで妥当性を検証しました。pFIは従来のFIに匹敵する精度で全身的健康状態を反映し、死亡や認知症を含む加齢関連疾患リスクを予測できることが示されました。SomaScanの高感度・大規模測定技術は、フレイル研究における従来の制約を克服し、臨床応用可能なバイオマーカー開発に大きく貢献したといえます。
研究例④ SomaScanは塞栓性脳梗塞と血栓性脳梗塞のリスクに関連するマーカーを同定しました
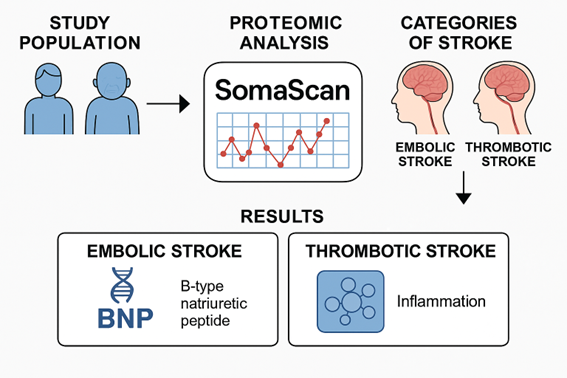
虚血性脳卒中は世界的に主要な死因であり、とくに塞栓性脳梗塞(EIS)と血栓性脳梗塞(TIS)では病態や治療反応が異なることが知られています。しかし従来の危険因子だけではその発症機序やサブタイプの違いを十分に説明できず、より個別化された予防・診断法が求められています。本研究は、大規模前向きコホートにおいて血漿プロテオームを網羅的に解析し、EISとTISそれぞれに関連する蛋白質シグネチャーを同定することを目的としました。特に、アプタマー技術を用いた大規模プロテオーム解析基盤 SomaScan を用いた点が特徴であり、これにより従来困難であった5,000種類以上の血漿蛋白質の高精度測定が可能となりました。
対象は米国4地域で進行中の ARIC(Atherosclerosis Risk in Communities)研究 の参加者です。1990–1992年(第2回調査, V2, 中年期)に血漿を採取した10,929名(平均年齢57歳、女性56%、黒人23%)と、2011–2013年(第5回調査, V5, 高齢期)に血漿を採取した4,463名を解析しました。既往脳卒中例は除外し、以降最大30年間追跡して発症した虚血性脳卒中を医師が厳密に判定しました。アウトカムは塞栓性脳梗塞(EIS)168例・血栓性脳梗塞(TIS)459例(中年期)、EIS 73例・TIS 124例(高齢期)でした。
血漿サンプルはSomaScan Ver.4(SomaLogic社)により4,955種類の蛋白質を定量化しました。Cox回帰モデルにより、蛋白質濃度とEIS・TIS発症リスクの関連を年齢・性別・人種・高血圧・糖尿病・脂質・BMI・喫煙・腎機能・心房細動の既往などで調整しました。さらにIngenuity Pathway Analysisを用いて関連経路を同定しました。
中年期解析(約20年追跡): 20種類の蛋白質がEISまたはTISと有意に関連しました。
- N末端プロB型ナトリウム利尿ペプチド(NT-proBNP)はEISと強く関連(HR=1.63, p=2.9×10^-15)、TISとは無関係であり、心原性機序を反映していました。
- 一方、成長分化因子15やインターロイキン12/23など炎症関連蛋白はTISと関連しました。
高齢期解析(平均追跡8年): 4種類の蛋白質がEISと関連し、TISに有意関連は認められませんでした。
- NT-proBNPとセリンプロテアーゼインヒビターKazal型4はEISリスク増加に関連。
- オリゴデンドロサイト髄鞘糖蛋白およびNeurocanはEISリスク低下に関連。
経路解析: EIS関連蛋白は癌やDNA修復、GABA受容体経路、補体カスケードなどを反映し、TIS関連蛋白は炎症や動脈硬化経路に集中していました。
年齢層ごとに異なる経路が浮かび上がり、加齢に応じた発症機序の違いが示唆されました。
本研究は、SomaScanによる大規模プロテオーム解析を用いて、塞栓性脳梗塞と血栓性脳梗塞のリスクに関連する特異的蛋白質シグネチャーを事前採血から同定しました。EISには心機能不全関連蛋白、TISには炎症・動脈硬化関連蛋白が関与し、さらに中年期と高齢期で関連蛋白や経路が異なることが示されました。これらの知見は、将来的に脳卒中予防や診断を個別化する上で重要な分子基盤を提供するものです。
SomaScanTM Assay についてご依頼、お見積り、技術的な説明、営業説明を希望される方はこちらをクリックください。



